ein Gleichgewichtszustand einstellt. Diese gemessene Zellenspannung wird somit auch Gleichgewichtspotenzial genannt.
Das Gleichgewichtspotenzial entsteht in diesem Falle zwischen zwei Elektroden, an denen jeweils eine Reaktion stattfindet. Man nennt diese Elektroden, an denen nur eine Reaktion stattfindet, Einfachelektroden.
Wenn eine Einfachelektrode nicht im Gleichgewicht ist, so weicht ihr Potenzial vom Gleichgewichtspotenzial ab, das sich nach der Nernstschen Gleichung in einem Elektrolyten einstellt.
Diese Differenz zwischen der gemessenen Zellenspannung und dem theoretisch berechneten Wert (nach Nernst) nennt man Überspannung. Die Überspannung bezieht man auf Einfachelektroden.
Theoretisch lässt sich aufgrund der Spannungsreihe der Metalle voraussagen, wann sich ein Metall auflöst. Alle Metalle, die unedler als Wasserstoff sind, beispielsweise Blei, Eisen oder Zink, haben das Bestreben, sich in Säuren unter Wasserstoffentwicklung aufzulösen.
Da das Potenzial des Wasserstoffs in der Spannungsreihe willkürlich = 0 gesetzt ist, könnte sich Eisen oder Zink bei pH 7 bereits unter Wasserstoffentwicklung auflösen.
In Wirklichkeit aber kann dieser Auflösevorgang erst bei einem pH-Wert von 3 bis 4 eintreten, weil neben der Spannungsreihe der Metalle für die Wasserstoffentwicklung die Überspannung von Bedeutung ist.
Die Ursache der Überspannung besteht in einer Hemmung der H2-Entwicklung, die entweder auf einer erschwerten Entladung der Wasserstoffionen oder auf einer Reaktionsverzögerung basiert. Wasserstoff hat an Quecksilber die größte und an Platin oder platiniertem Platin (Platinkatalysator) die geringste Überspannung. Blei, Eisen oder Zink weisen Zwischenwerte auf.
Nimmt man noch die Einflüsse der Schutzschichtbildung hinzu, so stellt man fest, dass die Spannungsreihe der Metalle zwar für die theoretischen Grundlagen von Bedeutung ist, für praktische Aussagen aber entsprechend den Umständen modifiziert werden muss.
Wenn zwei oder mehr Reaktionen gleichzeitig an einer Elektrodenoberfläche ablaufen spricht man von Mischelektroden oder Mehrfachelektroden. Hierbei setzt sich die Überspannung an einer einzelnen Elektrode aus mehreren Hemmungen einzelner Teilschritte der Elektrodenreaktion zusammen. Man spricht in diesem Falle von Polarisation. Hier eine Übersicht:
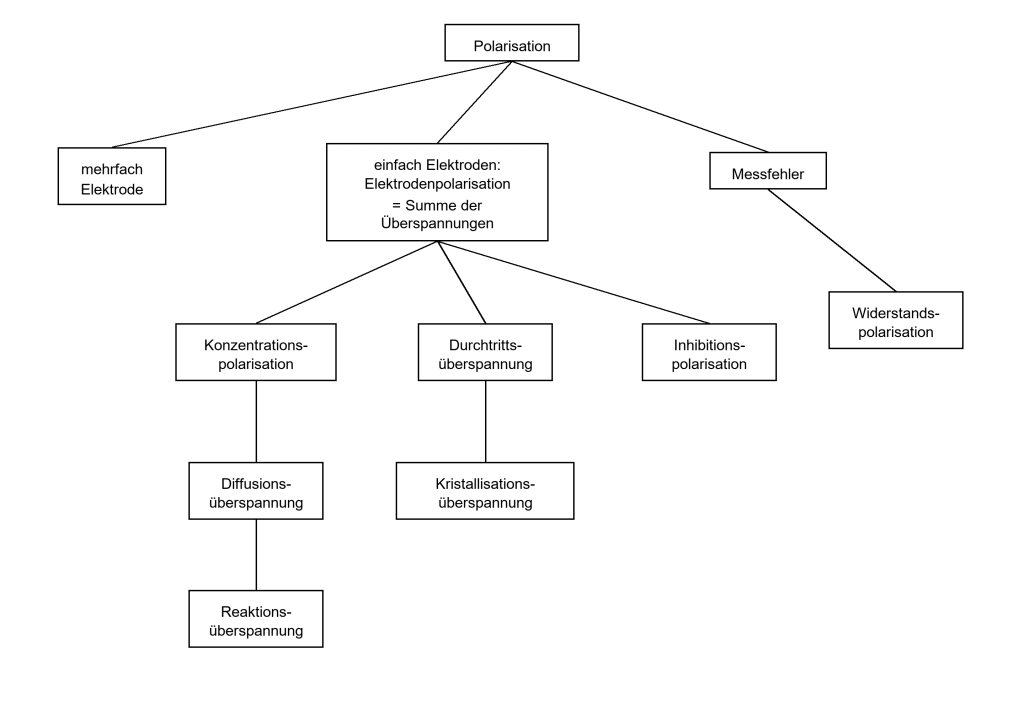
Die Begriffe Überspannung und Polarisation bezeichnen nichts anderes als eine Abweichung der (nach Nernst) berechneten Zellenspannung. Beide werden dadurch hervorgerufen, dass bei elektrochemischen Reaktionen die Ionen bei ihrer Entladung an den Elektroden gehemmt bzw. gestört werden. Deshalb ist bei der Abscheidung von Metallionen aus wässriger Lösung immer eine höhere Spannung erforderlich.
Da bei den elektrochemischen Reaktionen in der Galvanotechnik mehr als zwei Reaktionen an einer Elektrode stattfinden, spricht man allgemein von Polarisation. So wird z. B. bei der Abscheidung von Nickel– oder anderen Metallionen an der Kathode gleichzeitig Wasserstoff mit abgeschieden.
An der Anode findet neben einer Metallauflösung auch eine Sauerstoffabscheidung statt.
Grundsätzlich ist zu beachten, dass bei der kathodischen Metallabscheidung die Metallionenentladung (also die Reduktion der Metallionen zu Metallatomen) mit Überspannung, aber an polarisierter Elektrode verläuft. Der Begriff „Wasserstoffüberspannung“ kennzeichnet die Spannungsdifferenz für die Wasserstoffabscheidung an beliebigen Elektroden.
Er ist nicht identisch mit der „Polarisation einer Wasserstoffelektrode“.