Nach dieser Lektion können Sie das Grundprinzip der galvanischen Metallabscheidung beschreiben. Sie können das Faraday’sche Gesetz erklären und die wesentlichen Parameter der Metallabscheidung nennen. Außerdem können Sie weitere Einflussfaktoren nennen und die wesentlichen Badzusätze bezeichnen.
Die Abscheidung von Metallen in der Galvanotechnik beruht auf einem Elektrolyten, durch welchen Strom geleitet wird. Der Elektrolyt (eine Strom leitende Flüssigkeit) besteht u. a. aus Metallsalzen des abzuscheidenden Metalls (z. B. Nickel, Kupfer, oder Zink). Im Elektrolyten liegen die Metalle, wenn sie nicht komplexiert sind, als positiv geladenes Ion vor (z. B. Ni2+, Cu2+ oder Zn2+). Das Material, welches beschichtet werden soll, wird kathodisch geschaltet (Minuspol) und nennt man deshalb auch Kathode. Um einen geschlossenen Stromkreis zu erzeugen, braucht es den Gegenpol (Pluspol) welcher Anode genannt wird.
Merke: Die Kathode ist das Werkstück, welches galvanisiert werden soll. Es wird immer negativ geladen. Der Gegenpol ist die Anode. Sie ist positiv geladen.
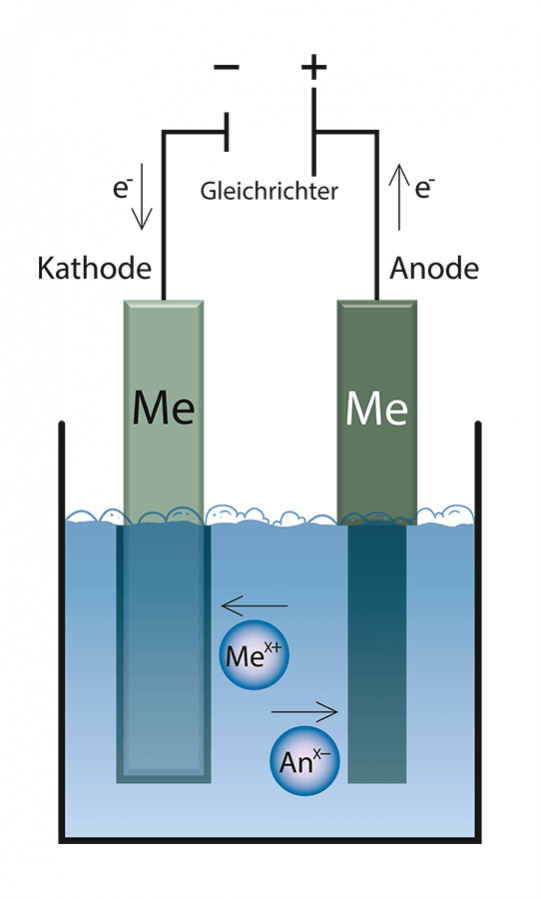
Die Anode besteht i. d. R. aus demselben Metall, welches abgeschieden werden soll (z. B. reines Nickel, Kupfer oder Zink). Bei speziellen Verfahren jedoch besteht die Anode aus unlöslichem Metall (z. B. Platin) oder aus einem nicht störenden Fremdmetall (z. B. Blei in Cr(VI)- Elektrolyten). Sobald der Strom angelegt wird beginnen die Ionen zum entgegengesetzten Pol zu wandern. Die positiven Metallionen (Kationen) wandern zur negativen Kathode (Werkstück) und werden durch die Aufnahme von Elektronen zum Metall reduziert. Je länger sich der Gegenstand im Bad befindet und je höher der elektrische Strom ist, desto stärker wird die Schichtdicke.
Merke: Die positiven Kationen wandern im elektrischen Feld (Elektrolyt) zur negativen Kathode. Die Wanderung von Ionen im Elektrolyt nennt man Migration.
Vereinfachtes Beispiel einer Produktion. In Galvaniken gelangen Teile einzeln oder in Massen von Wanne zu Wanne.
Zur gleichen Zeit, da an der Kathode (Werkstück) die Metallionen (Kationen) zum Metall reduziert werden, wird an der Anode das Metall aufgelöst, z. B. entsteht aus dem metallischen Nickel das Ni2+ – Ion. Somit ist der Kreislauf geschlossen und durch die Metallauflösung an der Anode kommt es nicht zu einer Verarmung an Metallionen im Elektrolyten. Bei Verfahren mit Fremdmetall-Anoden muss der Metallgehalt des Elektrolyten durch Zugabe von Metallsalz ausgeglichen werden.
Merke: Die negativen Anionen wandern im Elektrolyt zur positiven Anode. Gleichzeitig löst sich das Metall an der Anode und wandert in die entgegengesetzte Richtung zur Kathode.
Allgemeine Kathodenreaktion: ![]()
Das Kation (Mex+) nimmt die Anzahl an Elektronen auf, die es braucht, um zum Metall zu werden. Im Fall von Nickel (Ni2+) nimmt es sich zwei Elektronen. Aus dem Ion wird ein nach Außen hin neutrales Atom.
Allgemeine Anodenreaktion: ![]()
Hinweis: Der vollständige Kurs „Einstieg in die Galvanotechnik“ geht an dieser Stelle noch weiter.