Elektrolyse ist ein Oberbegriff in der Chemie, unter dem alle durch Stromeinwirkung ausgelösten, verstärkten oder veränderten Reaktionen fallen. Die Reaktionen in einer Batterie gehören hierbei ebenso dazu wie die galvanischen Vorgänge, mit denen sich dieses Lexikon gewöhnlich beschäftigt.
Unter Elektrolyse im Galvanotechnischen Sinne versteht man, die unter der Einwirkung des elektrischen Stroms erzeugten Redoxreaktionen, die zur chemischen Umsetzung der Elektrolytinhaltstoffe und der Elektrodenwerkstoffe führen.
Auch die elektrolytische Auflösung von Metallen oder die Abscheidung aus einem wässrigen Medium zur Reinigung oder zur Schichterzeugung wird hier gewöhnlich als Elektrolyse bezeichnet.
Hierunter fallen:
Die Elektrolyse ist die Umkehrung der Vorgänge in einer Batterie, der Entladung eines Akkumulators oder des Betriebs einer Brennstoffzelle.
Bei der Elektrolyse wird elektrische Energie in chemische Energie umgewandelt.
Besonders im Falle der Wasserzerlegung in Wasserstoff und Sauerstoff ist das auch Ziel der Elektrolyse.
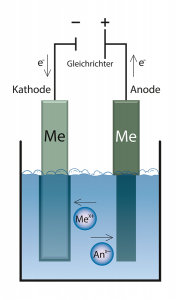
Durch zwei Elektroden wird ein elektrischer Gleichstrom durch eine leitfähige Flüssigkeit (Elektrolyt) geleitet. An den Elektroden entstehen durch die Elektrolyse Reaktionsprodukte aus den im Elektrolyten enthaltenen Stoffen.
Die Spannungsquelle bewirkt einen Elektronenmangel in der mit dem Pluspol (Anode) verbundenen Elektrode und einen Elektronenüberschuss in der anderen, mit dem Minuspol (Kathode) verbundenen Elektrode. Die Lösung (Elektrolyt) zwischen der Kathode und Anode enthält als Ladungsträger positiv und negativ geladene Ionen. Die positiv geladenen Kationen wandern durch das Anlegen einer Spannung zur negativ geladenen Kathode. An der Kathode nehmen sie ein oder mehrere Elektronen auf und werden dadurch reduziert. An der Anode läuft der entgegengesetzte Prozess ab. Dort geben die negativ geladenen Anionen Elektronen ab, werden also oxidiert. Bei löslichen Anoden wird durch die Elektronenabgabe das Metall zur Ionenform oxidiert und geht dadurch in Lösung. Die Menge der an der Anode übertragenen Elektronen ist gleich der an der Kathode übertragenen.
Die Spannung, die zur Elektrolyse mindestens angelegt werden muss, wird als Zersetzungsspannung (Uz oder Ez) bezeichnet. Diese oder eine höhere Spannung muss angelegt werden, damit die Elektrolyse überhaupt abläuft. Wird diese Mindestspannung nicht überschritten, hemmt eine isolierende Doppelschicht die elektrochemischen Umsetzungsreaktionen.
Für jeden Stoff, für jede Umwandlung von Ionen zu zwei oder mehratomigen Molekülen kann die Zersetzungsspannung, das Abscheidepotential anhand des Redoxpotentials ermittelt werden. Aus dem Redoxpotential erhält man noch weitere Hinweise, wie die zur elektrolytischen Zersetzung von Metallelektroden in Säure oder zur Veränderung der Zersetzungsspannung in Abhängingkeit vom pH-Wert. So lässt sich durch das Redoxpotential berechnen, dass die anodische Sauerstoffbildung bei der Wasserelektrolyse von Wasser in basischer Lösung (Zersetzungsspannung: 0,401 V) unter geringerer Spannung abläuft als in saurer (Zersetzungsspannung: 1,23 V) oder neutraler (Zersetzungsspannung: 0,815 V) Lösung, an der Kathode hingegen bildet sich Wasserstoff leichter unter sauren Bedingungen als unter neutralen oder basischen Bedingungen. Dies erklärt sich aus der Definition von pH- und pOH- Wert, nach der ein geringer pH- Wert (saure Reaktion) einer hohen Konzentration an Wasserstoffionen (großes Angebot an Wasserstoff), ein hoher pH- Wert dagegen einem hohen Gehalt an OH–-Ionen (basische Reaktion) entspricht (großes Angebot an zerlegbaren OH–– Ionen).
Sind in einer Elektrolytlösung mehrere reduzierbare Kationen vorhanden, so werden zunächst die Kationen reduziert, die in der Redoxreihe (Spannungsreihe) ein positiveres (edleres) Potential haben. Bei der Elektrolyse einer wässrigen Kochsalzlösung bildet sich an der Kathode immer Wasserstoff und nicht Natrium, da die Wasserstoffionen des Wassers edler reagieren als das äußerst unedle Natrium. Auch beim Vorliegen von mehreren Anionenarten, die oxidiert werden können, kommen zunächst diejenigen zum Zuge, die in der Redoxreihe möglichst nahe am Spannungsnullpunkt liegen, also ein schwächeres positives Redoxpotential besitzen.
Nach Überschreiten der Zersetzungsspannung wächst mit Spannungszunahme proportional auch die Stromstärke. Nach Faraday ist die Gewichtsmenge eines elektrolytisch gebildeten Stoffs proportional zu der geflossenen elektrische Ladung (Stromstärke multipliziert mit der Zeit, siehe Faradaysche Gesetze). Für die Bildung von 1 g Wasserstoff (etwa 11,2 Liter, bei der Bildung eines Wasserstoffmoleküls werden zwei Elektronen benötigt) aus wässriger Lösung wird eine elektrische Ladung von 96485 C (1 C = 1 A•s) benötigt. Bei einem Strom von 1 A dauert die Bildung von 11,2 Litern Wasserstoff also 26 Stunden und 48 Minuten (=96485 s).
Neben dem Redoxpotential ist noch die Überspannung (das Überpotential) von Bedeutung. Auf Grund von kinetischen Hemmungen an Elektroden benötigt man häufig eine deutlich höhere Spannung als sich dies aus den Redoxpotentialen errechnet. Die Überspannungseffekte können – je nach Materialbeschaffenheit der Elektroden – auch die Redoxreihe ändern, so dass andere Ionen oxidiert oder reduziert werden als dies nach dem Redoxpotential zu erwarten gewesen wäre.
Kurz nach Abschaltung einer Elektrolyse kann man mit einem Amperemeter einen Stromausschlag in die andere Richtung feststellen. In dieser kurzen Phase setzt der umgekehrte Prozess der Elektrolyse, die Bildung einer galvanischen Zelle ein. Hierbei wird nicht Strom für die Umsetzung verbraucht, sondern es wird kurzzeitig Strom erzeugt; dieses Prinzip wird bei Brennstoffzellen genutzt. Ursache dieses Phänomens ist bei der Elektrolysezelle die Auflösung der Elektrodenfilme im Elektrolyten. Dadurch wird das durch den Stromfluss entstandene dynamische Ungleichgewicht der Elektrolyse ausgeglichen, was eine kurze Potentialumkehrung erzeugt.
Mitunter ist es ratsam, zur Vermeidung unerwünschter chemischer Reaktionen Kathodenraum und Anodenraum voneinander zu trennen und den Ladungsaustausch zwischen Anoden- und Kathodenraum nur durch ein poröses Diaphragma – häufig ein Ionenaustauscherharz – stattfinden zu lassen. Bei der technischen Elektrolyse zur Herstellung von Natronlauge ist dies recht wichtig. Zur Verfolgung von Stoffumsatz, Wanderungsgeschwindigkeiten von Ionen kann auch das Wissen von molaren Grenzleitfähigkeiten wichtig sein.
Wenn man durch eine Elektrolyse eine Trennung einzelner Moleküle oder Bindungen erzwingt, wirkt gleichzeitig ein galvanisches Element, dessen Spannung der Elektrolyse unter Umständen entgegenwirkt. Diese Spannung wird auch als Polarisationsspannung bezeichnet.