Nach dieser Lektion können Sie den Abscheidemechanismus charakterisieren und die einzelnen Schritte erklären.
Um ein besseres Verständnis für die Vorgänge bei der Elektrolyse zu erhalten, wird nachfolgend auf Kathodenreaktionen am Beispiel von Nickel eingegangen.
Grundsätzlich muss man sich vor Augen halten, dass man mit der Kathode einen Festkörper in eine Flüssigkeit (Elektrolyt) eintaucht. Den Übergang von Fest (Kathode) zur Flüssigkeit nennt man Phasengrenze. An Phasengrenzen finden Reaktionen statt, die weder im Material noch in der Flüssigkeit (oder in Gasen) so, oder in dieser Form, vorkommen. Ein geläufiges Beispiel hierfür ist die Korrosion. Sie findet nur statt, wenn Metall mit seiner Umgebung reagiert.
Die Stoffe, die sich im Elektrolyten befinden, finden sich auf Grund der Gleichverteilung auch alle vor der Kathodenoberfläche wieder. Stoffe, die sich unmittelbar vor der Kathodenoberfläche befinden, werden in die Schicht mit eingebaut. Das kann zu Fehlern beim Schichtaufbau führen. Diesen Effekt kann man aber andererseits gezielt ausnutzen, um die Schichteigenschaften zu steuern. Dazu werden dem Elektrolyten die verschiedensten Stoffe, meist in Konzentrationen von nur wenigen mmol/L, zugesetzt.
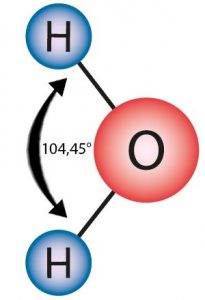
Der wichtigste Stoff in den üblichen Elektrolyten ist Wasser. Das Wassermolekül H2O ist ein Dipol. Das kommt daher, dass die Wassermoleküle nicht symmetrisch (H-O-H) in einer Reihe liegen. Die Bindung schließt einen Winkel von 104,45° ein. Damit fallen die Schwerpunkte der negativen Ladung (am Sauerstoff) und der positiven Ladungen (in der Mitte zwischen den Wasserstoffmolekülen) nicht mehr zusammen. In einem elektrischen Feld wird das Wassermolekül entsprechend ausgerichtet (polares Molekül).
Die galvanische Abscheidung arbeitet in der Regel mit Gleichstrom. Hierdurch werden die Wassermoleküle in einer konstanten Richtung ausgerichtet. An der Kathodenoberfläche ist nach dem Einschalten des Stromes ein Überschuss negativer Ladungen vorhanden. Die Wassermoleküle lagern sich entsprechend mit ihrer positiven Seite, den Wasserstoffatomen, an die Oberflächen der Kathode an.
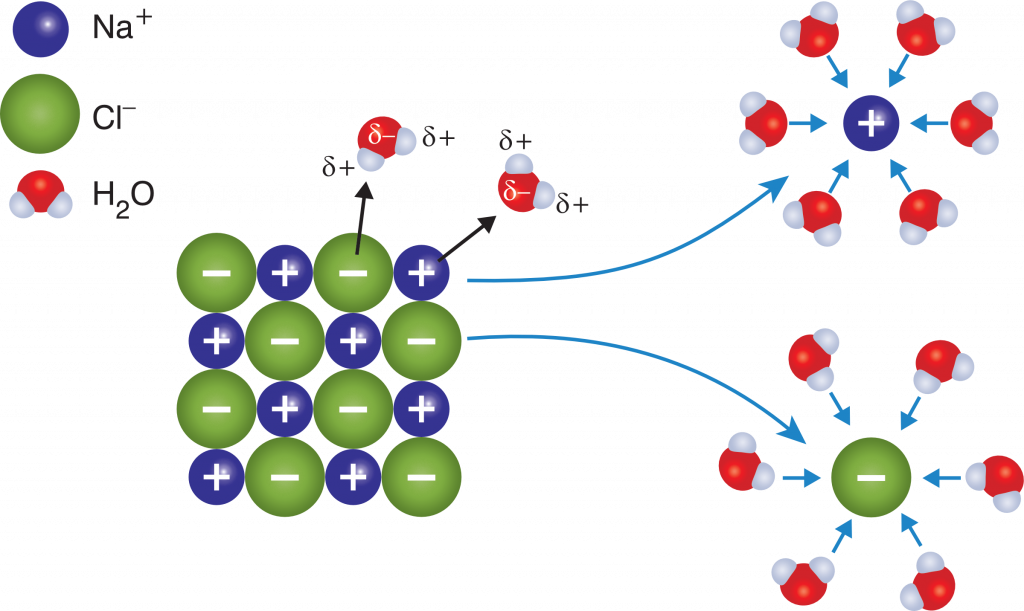
Dabei bildet sich eine elektrische Doppelschicht, eigentlich mehrere elektrische Doppelschichten, aus. Die ersten Wassermoleküle sind relativ fest gebunden. Zu den üblichen Adhäsionskräften des benetzenden Wassers kommen noch die elektrischen Anziehungskräfte durch die Kathode. Für die Wassermoleküle, die nicht mehr unmittelbar an der Kathodenoberfläche sitzen, wirken nur noch die relativ geringen Kohäsionskräfte zwischen den Wassermolekülen. Je größer die Entfernung bis zur Kathode wird, umso weniger sind die Wassermoleküle ausgerichtet und umso stärker bewegen sie sich infolge der Wärmebewegung (Brownsche Bewegung).
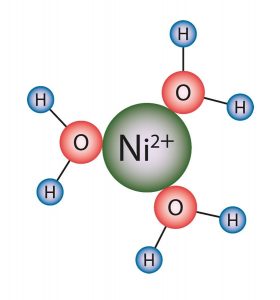
Aufgrund der Dipol-Eigenschaft ist Wasser ein hervorragendes Lösemittel. Die Metallsalze im Elektrolyt werden, je Kation und Anion, von Wassermolekülen umgeben. Um das Kation lagert sich die negative Seite des H2O-Moleküls an, um das Anion die positive Seite. Eine solche Anhäufung entgegengesetzter Ladungen um ein Zentralion nennt man Ionenwolke. Der Abstand zwischen Ionen entgegengesetzter Ladung ist dabei kleiner als der zwischen gleich geladenen Ionen. Dabei darf man nicht vergessen, dass es sich nicht um einen starren Verband handelt. Die statistische Nahordnung wird durch die Wärmebewegung ständig verändert.
Die Ionen müssen, um abgeschieden zu werden, vom Elektrolytinneren bis zur Kathodenoberfläche gelangen. Die Anode soll hier nicht betrachtet werden, weil es sich im Prinzip um die gleichen Schritte in umgekehrter Reihenfolge handelt.
Die drei Grundeigenschaften der Ionen führen auch zu drei unterschiedlichen Transportmöglichkeiten:
Aus dem Elektrolytinneren gelangen die Ionen bei Rührung zunächst mit hoher Geschwindigkeit durch Konvektion bis in die Nähe der Elektrolytoberfläche. Da der Elektrolyt benetzend wirkt, haften die Moleküle, die sich direkt an der Oberfläche befinden, an (Adhäsionskraft > Kohäsionskraft). Auf Grund dessen, dass diese Fläche die Elektrolytmoleküle festhält, können sich die nächsten Schichten nur entlang der Oberfläche bewegen und nicht quer dazu. Es findet eine laminare Strömung (Schichtenströmung) entlang der Oberfläche statt, wobei die Geschwindigkeit nach außen hin zunimmt. Im Inneren des Elektrolyten kann auch Wirbelströmung stattfinden. Wirbelströmung heißt, der Transport ist auch quer zur Oberfläche möglich. Aufgrund der Metallabscheidung nimmt die Konzentration der Metallionen hin zur Kathode ab. Dieses Konzentrationsgefälle ist der Antrieb für die Diffusion. Anionische Metallverbindungen (etwa [Zn(OH)4]2-) gelangen vorwiegend durch die Diffusion an die Kathode.
Je stärker die Rührung, umso dünner ist die Strömungsgrenzschicht und umso dünner die Diffusionsschicht. Daraus folgt, dass der Konzentrationsgradient als Antrieb für die Diffusion mit steigender Rührung größer wird.
Hinweis: Der vollständige Kurs „Einstieg in die Galvanotechnik“ geht an dieser Stelle noch weiter.