Potenzial einer elektrochemischen Redoxreaktion Red ↔ Ox + z e– mit dem Redoxpotenzial:
![]()
Das Elektrodenmaterial ist dabei inert, d. h. es wird nicht angegriffen und ist somit nicht an der Reaktion beteiligt.
Eine angreifbare Elektrode ist z. B.:
![]()
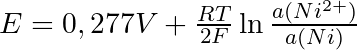
wobei die Aktivität des reinen Metalls 1 ist.
Ein wichtiges Redox-Potenzial ist das des Wasserstoffs (pH-Wert-Messung).