Elektrochemisches Äquivalent
In der Galvanotechnik häufig als → Abscheidungsäquivalent bezeichnet.
- Verhältnis der Masse m, die durch eine Elektrizitätsmenge Q umgesetzt wird (g/Ah, oder mg/As), zu folgender Elektrizitätsmenge:
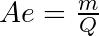
- Strommenge, durch die ein Mol (Äquivalent) eines Stoffs umgesetzt wird. Diese wird 1 Faraday (F) genannt (1 F = 96 487 C); Faradaysches Gesetz:
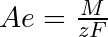
Weitere Begriffe aus dieser Kategorie